Notificações de hipertensão do Apple Watch recebem aprovação do regulador
A mais recente funcionalidade de saúde para os modelos recentes do Apple Watch recebeu luz verde da FDA, o que significa que a Apple pode ativá-la e incluí-la de fábrica no Apple Watch Series 11.
Apple lança nova funcionalidade regulada pelas autoridades
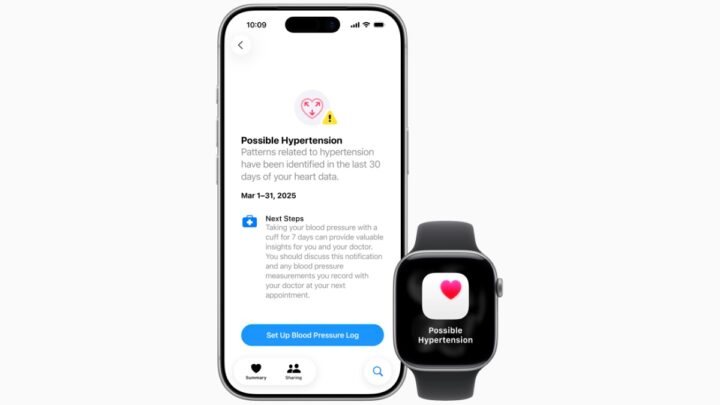
O Apple Watch tornou-se num poderoso companheiro de saúde que monitoriza uma grande variedade de métricas para dar aos utilizadores informações úteis. Cada geração traz algum novo parâmetro de monitorização, e a Apple revelou as notificações de hipertensão juntamente com o Apple Watch Series 11.
Um relatório recentemente partilhado indica que as notificações de hipertensão passaram agora pela aprovação da FDA e podem ser ativadas nos modelos compatíveis do Apple Watch. É uma funcionalidade que será incluída no Apple Watch Series 11 e no Apple Watch Ultra 3 a 19 de setembro.
As notificações de hipertensão no Apple Watch utilizam dados do sensor ótico de ritmo cardíaco para analisar como os vasos sanguíneos do utilizador respondem aos batimentos do coração. O algoritmo funciona de forma passiva em segundo plano, revendo dados em períodos de 30 dias, e notificará os utilizadores se detetar sinais consistentes de hipertensão.
Estas notificações fornecem aos utilizadores informações valiosas sobre a sua saúde no que toca a esta condição tão comum, simplesmente ao usarem o Apple Watch, permitindo-lhes começar a adotar mudanças de comportamento que podem salvar vidas ou iniciar tratamento para reduzir o risco de problemas de saúde graves a longo prazo.
Apple Watch: versões mais antigas também recebem
A funcionalidade também chegará a Apple Watches mais antigos, Apple Watch Series 9, Apple Watch Series 10 e Apple Watch Ultra 2. No entanto, é difícil dizer exatamente quando ficará disponível.
A Apple poderá ativá-la remotamente ou através da atualização do watchOS 26, que será disponibilizada ao público na próxima segunda-feira.
As notificações de hipertensão utilizam dados recolhidos ao longo de um período de 30 dias sobre como o sangue flui através dos vasos sanguíneos. O novo sistema consegue determinar se a pressão arterial está mais alta do que o esperado e acompanhar a gravidade da condição.
Isto não corresponde a medir a pressão arterial nem a fornecer esses dados. O que faz é notificar os utilizadores sobre uma possível hipertensão, dando-lhes a oportunidade de consultar um médico ou começar a medir a pressão arterial com uma braçadeira.
A Apple está a lançar o watchOS 26 e o iOS 26 a 15 de setembro e, depois, a comercializar os novos Apple Watch e iPhones a 19 de setembro. A nova funcionalidade de notificações de hipertensão deverá alertar 1 milhão de utilizadores no primeiro ano.

























Recebeu aprovação … do FDA, o regulador dos EUA.
E a marca CE, de conformidade segundo a legislação da UE?
Estou em crer que não precisa. O Apple Watch não vai ser comercializado como dispositivo para medir a tensão arterial – uma vez que não a mede – antes avalia o risco de se ter hipertensão arterial e nesse caso emite um aviso.
P.S. Se medisse a tensão arterial era um dispositivo médico de risco, da Classe IIa e, para ter a marca CE (não falsificada) o fabricante tinha que pedir a um Organismo Notificado que certificasse a conformidade.
não conheço nada que seja aprovado pela FDA que seja rejeitado em algum outro regulador
1. Aducanumab (Aduhelm)
– FDA: aprovado em junho de 2021 para Alzheimer leve
– EMA: rejeitado em dezembro de 2021 por benefícios não comprovados
2. Pimavanserina (Nuplazid)
– FDA: aprovado em abril de 2016 para psicose na doença de Parkinson
– MHRA (Reino Unido): negado em 2017 por dados de segurança insuficientes
3. Brodalumabe (Siliq/Kyntheum)
– FDA: aprovado em fevereiro de 2017 para psoríase (com alerta de ideação suicida)
– EMA: recusado em maio de 2017 por preocupações de segurança
4. Lemborexant (Dayvigo)
– FDA: autorizado em dezembro de 2019 para insônia
– EMA: rejeitado em 2020 por falta de dados de segurança a longo prazo
5. Rimonabanto (Acomplia/Zimulti)
– FDA: recusado em 2006
– EMA: aprovado em 2006–2007 para obesidade; suspenso em 2009 por efeitos psiquiátricos
Reflexões:
– Critérios de risco/benefício variam entre agências
– Aprovações aceleradas do FDA às vezes divergem da EMA
– Importância de avaliações contínuas pós-aprovação
Estamos a falar, digo eu, de dispositivos Apple.
Estava a falar de medical devices e não medicamentos.
Mesmo non apple não conheço nada que não tenha seguido o ciclo de aprovação pós aval da FDA, até porque não existe entidade mais competente no mundo que a FDA, os outros estão a anos luz
Também é verdade. Mas o Max levantou uma boa questão.
Segundo o que pode ser lido, a Apple diz que espera aprovação de “outros reguladores” e que a funcionalidade será disponibilizada também na UE, mas isso não é o mesmo que um documento público que mostre «CE granted» para a função de notificações de hipertensão.
Então e qual é a diferença? Na União Europeia o software/funcionalidade com finalidade médica pode precisar de CE ao abrigo do MDR (Regulamento (UE) 2017/745). O processo envolve avaliação de conformidade (e, quando aplicável, um notified body).
Pode ser este caso. No fundo, o que dizes é o que tem sido a realidade, depois da FDA aprovar, os outros reguladores, mais tarde ou mais cedo, dão o memso OK.
Não interessa, a marca FDA vale para os EUA, na UE vale a marca CE.
Em dispositivos médicos (o Apple Watch não é um dispositivo médico), para a obter a marca CE da UE tem regras. Os dispositivos médicos são classificados segundo o risco. Na Classe I geral (baixo risco) é o próprio fabricante que avalia a conformidade. Nos com risco, alguns da classe I, da classe II (um medidor de tensão arterial é IIa) e da classe III – é obrigatória a intervenção de um Organismo Notificado para o fabricante colocar a marcação CE
Até os que vendem dispositivos fraudulentos sabem e põem as duas marcas, FDA e CE, como mostra a imagem num aviso do Infarmed
https://www.infarmed.pt/documents/15786/10773033/Compras+online+-+Dispositivos+não+invasivos+para+a+medição+da+glicémia+fraudulentos/14e10fb0-6603-00f5-61ba-773a3fb84e00?version=1.0